30.11.2017
2 minutes de lecture
Les enjeux climatiques nécessitent le développement d’un mix énergétique privilégiant les énergies décarbonées.
IFPEN y contribue par différentes voies, dont celle des biocarburants à partir de ressources non alimentaires.
La production d’éthanol lignocellulosique (ou éthanol 2G) nécessite une étape d’hydrolyse enzymatique afin de transformer la cellulose en glucose, qui sera ensuite transformé en éthanol par fermentation alcoolique. Cette étape est réalisée par voie enzymatique mais constitue un des verrous économiques majeurs au développement du procédé à cause du coût élevé des enzymes, appelées cellulases.
La plupart des cellulases industrielles sont produites par le champignon filamenteux Trichoderma reesei, grâce à sa forte capacité de sécrétion, qui permet d’atteindre des concentrations supérieures à 100 g/l[1]. Le procédé classique de production développé à IFPEN est conduit en deux étapes, une étape en mode batch et une étape en mode fed-batch :
- la première étape consiste à cultiver le champignon dans des fermenteurs agités et aérés de plusieurs centaines de m3. Une agitation très intense est requise durant cette étape pour favoriser le transfert d’oxygène de l’air vers les micro-organismes. La morphologie filamenteuse du champignon est à l’origine du comportement rhéologique non newtonien* du milieu et défavorise à forte concentration ce transfert[2]. En effet, la viscosité augmente lorsque la concentration en champignons augmente, d’où la nécessité d’apporter une puissance d’agitation très conséquente[3].
- une fois le milieu fermentaire suffisamment concentré en biomasse filamenteuse, on passe en mode fed-batch, avec la mise en place d’une alimentation par un flux en sucre inducteur. Ce flux est limitant, c'est-à-dire qu’il est inférieur à la capacité maximale de consommation des champignons et provoque un changement métabolique. La culture passe alors en étape de production, durant laquelle les champignons produisent les enzymes recherchées (les cellulases).
La technologie d’agitation des fermenteurs industriels est critique pour la production d’enzymes car elle doit assurer des conditions optimales en termes de transfert d’oxygène et d’homogénéisation des concentrations en substrats, tout en respectant une double contrainte : limiter la consommation énergétique et minimiser l’impact mécanique du cisaillement sur les micro-organismes. Ce dernier point a suscité un effort de recherche significatif à IFPEN depuis quelques années. Cela a été rendu possible par le développement d’outils de caractérisation innovants, concernant la caractérisation de la rhéologie des milieux[4] et le traitement d’images pour la morphologie des champignons filamenteux[5], tel qu’illustré en figure 1.
Ces outils ont été appliqués à la caractérisation de fermentations réalisées dans des conditions d’agitation très variées en termes de puissance fournie, de type de mobile d’agitation et de taille de fermenteur. Les données obtenues, d’une richesse unique dans ce domaine, ont permis d’identifier les descripteurs hydrodynamiques pertinents pour prédire la rhéologie, la morphologie et les performances fermentaires du champignon filamenteux.
* dont la viscosité varie avec le taux de cisaillement.

Figure 1 : Culture de Trichoderma reesei dans un fermenteur de 3 l et image issue d’une analyse microscopique de la morphologie des champignons
En comparaison à différents critères classiquement utilisés pour quantifier le cisaillement, le critère apparaissant comme le plus pertinent est le critère dit EDCF-εmax pour Eddy dissipation/Circulation Function. Ce critère est défini par le ratio entre la dissipation énergétique maximale dans le sillage des pâles du mobile d’agitation (εmax) et le temps moyen séparant deux passages du champignon dans la zone de plus forte agitation (temps de cycle). Le critère EDCF-εmax est notamment très bien adapté pour extrapoler à plus grande échelle les fermentations étudiées au laboratoire car il offre une très bonne corrélation avec des grandeurs clefs (rhéologie, morphologie, croissance du champignon) et permet ainsi une démarche prédictive sur les performances quantitatives des fermenteurs industriels. Ceci est illustré à la figure 2 qui présente l’évolution des grandeurs d’intérêt durant la phase de croissance, vis-à-vis du critère retenu.
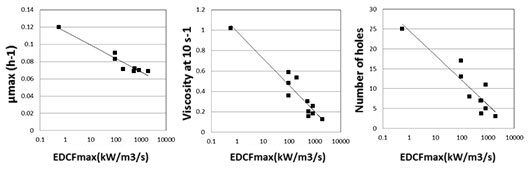
Figure 2 : Mise en évidence de la dépendance respective du taux de croissance, de la viscosité et de la morphologie vis-à-vis du critère EDCF-εmax.
Durant la phase de production d’enzyme, une baisse quantitative de celle-ci a été observée sous l’effet d’une trop forte agitation. Une analyse protéomique des protéines intracellulaires à différents niveaux d’agitation montre que le type de protéines synthétisées est affecté, avec une diminution de la production de cellulases désirées au profit d’une augmentation de la synthèse de protéines de réponse au stress et de celles impliquées dans le métabolisme central. Ce résultat suggère une plus grande dépense d’énergie pour la maintenance cellulaire au détriment de la production de cellulases[6].
Le critère EDCF-εmax pouvant aussi être facilement relié à des propriétés de mobiles d’agitation connues, comme leur capacité intrinsèque de pompage et de puissance énergétique, il constitue aussi une aide précieuse pour le choix des futures technologies d’agitation.
Les travaux ont été menés en grande partie en collaboration avec les Professeurs C. Béal d’AgroParisTech et A.W. Nienow de l’université de Birmingham, dans le cadre d’une thèse financée par l’Ademe, conduite au sein d’IFPEN et soutenue en 2016[7].
Témoignages de l'équipe de thèse de Nicolas Hardy :
Les travaux réalisés ont été salués par la communauté scientifique, comme l’atteste, d’une part, l’attribution du prix du meilleur poster lors du congrès SFGP 2017[6] dans la catégorie Innovations dans les bioproductions et, d’autre part, l’illustration de la couverture du volume 173 de décembre 2017 du journal Chemical Engineering Science[8, 9].
Contacts scientifiques : Frédéric Augier - fadhel.ben-chaabane@ifpen.fr
Publications
[1] Ben Chaabane F, Chaussepied B. Process for the continuous production of cellulases by a filamentous fungus using a carbon substrate obtained from an acid pretreatment.
>> US Patent 9249402 B2; 2016
[2] Gabelle J.C., Jourdier E., Licht R., Ben Chaabane F., Henaut I., Morchain J., Augier F., Impact of rheology on the mass transfer coefficient during the growth phase of Trichoderma reesei in stirred bioreactors, Chem.Eng.Sci, 75, 408-417, 2012.
>>DOI:1 0.1016/j.ces.2012.03.053
[3] Gabelle J.C., Augier F., Carvalho A., Rousset E., Morchain J., Effect of Tank Size on kLa and Mixing Time in Aerated Stirred Reactors With Non-Newtonian Fluids., Can.J.Chem.Eng., 89, 2011.
>> DOI: 10.1002/cjce.20571
[4] Hardy N., Henaut I., Augier F., Béal C., Ben Chaabane F., Rhéologie des champignons filamenteux : un outil pour la compréhension d’un procédé de production de biocatalyseurs utilisés pour la production de bioéthanol, Rhéologie, Vol. 27, 43-48, 2015.
>> https://www.researchgate.net/publication/305267699
[5] Hardy N., Moreaud M., Guillaume D., Augier F., Nienow A., Béal C., Ben Chaabane F., Advanced digital image analysis method dedicated to the characterization of the morphology of filamentous fungus, Journal of Microscopy, Vol. 266, Issue 2 2017, pp. 126-140.
>> DOI: 10.1111/jmi.12523
[6] Nicolas Hardy, Fadhel Ben Chaabane, Frédéric Augier, Alvin W. Nienow, Catherine Béal. Identification of fluid dynamic stress response of T. reesei during continuous fermentations conducted at high agitation rate. 16ème Congrès de la Société Française de Génie des Procédés (SFGP), Jul 2017, Nancy, France
>> HAL-01561070
[7] Nicolas Hardy. Thèse de Doctorat : Identification des critères d’extrapolation du procédé de production de cellulases par Trichoderma reesei en utilisant l’approche "scale-down", 2016
>> HAL-01637274
[8] Hardy N, Augier F, Nienow A. W., Béal C., Ben Chaabane F., Scale-up criteria for Trichoderma reesei fermentation, Chemical Engineering Science, 172, 2017, pp 158-168
>> DOI: 10.1016/j.ces.2017.06.034
[9] Cover page, Chem.Eng.Sci, Vol 173, Dec 2017
>> DOI: 10.1016/S0009-2509(17)30562-6






